Kritický bod
Z Multimediaexpo.cz
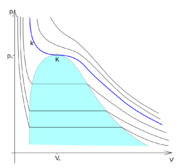
Kritický bod je bod na fázovém diagramu, který zakončuje křivku vypařování (bod K na obrázku). Tento bod určuje kritický stav látky. Stavové veličiny \(p_k\), \(T_k\) a \(V_k\) v tomto bodě se nazývají kritický tlak, kritická teplota a kritický objem.
Vlastnosti
V kritickém stavu mizí rozdíl mezi kapalinou a její párou. Při teplotě vyšší než kritická teplota \(T_k\) nemůže látka existovat v kapalném skupenství. Plyn, který má teplotu vyšší než je kritická teplota, nelze žádným stlačováním zkapalnit.
Zobrazením izoterm v p-V diagramu (viz obrázek) je vidět, že v oblasti sycení (označeno barevně) dochází k vypařování kapaliny (popř. kapalnění par). Nad kritickým bodem \(K\) však již oblast sycení neexistuje a k fázové změně tam tedy nemůže dojít. Izoterma \(k\), která prochází kritickým bodem \(K\), je kritickou izotermou. Při vyšších teplotách , tzv. nadkritických, již izotermy neprochází oblastí sycení a nelze provést zkapalnění a látka existuje pouze v plynné fázi.
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |